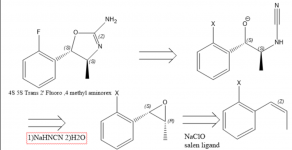
Интерес к 4-Метиламинорексу и его производным преобладает отчасти из-за его дефицита. Фармакологические исследования показывают, что энатиомеры 4 метиламинорекса располагаются в следующем порядке: транс-4S,5S > цис-4S,5R ~ цис-4R,5S > транс-4R,5R, а рацемический транс метиламинорекс считается более мощным, чем цис (1), поэтому направленный синтез на транс 4S, 5S энатиомер является очень желательным. В 1970 году был опубликован патент на синтез аминорекса из оксида стирола с использованием цианамида (2), что может намекать на то, что энатиочистый оксид стирола или бета-метилстирол/пропенилбензол оксид приведут к требуемому изомеру метиламинорекса (2). Для получения производного 4S,5S необходимо использовать эпоксид 1S,2R пропенилбензола, поскольку стереохимия в этом хиральном центре инвертирована. Эпоксид легко получить путем эпоксидирования по Якобсену(3), однако я не знаю лучшего способа получения замещенных пропенилбензолов в краткой форме.

Во-вторых, очевидно, что возможно появление нового психоактивного производного класса 2-аминооксазолинов, как это наблюдается в случае индановых производных амфетамина, таких как метилендиокси-2-аминоиндан (MDAI), и отсюда следует, что циклический эквивалент норэфедрина, цис-2-амино-1-инданол, при обработке цианогенбромидом также даст 2-аминооксазолины(4). В приведенном ниже примере стереохимия индана составляет 1R,2S, поскольку ожидается, что он будет более мощным, чем энатиомер. Синтез этого соединения лучше всего осуществлять путем внутримолекулярного ацилирования по Фриделю анти/трео 1R,2R бета-гидрокси фенилаланина (5). Однако существуют трудности в получении этого соединения, оно может быть получено аминогидроксилированием циннамата с последующей инверсией Мицунобу (6) или окислением бета-бром-фенилаланина нитратом серебра (7).


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Патент+2101424 (b) примеры использования цианамида натрия для получения 2-аминооксазолинов; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Во-вторых, очевидно, что возможно появление нового психоактивного производного класса 2-аминооксазолинов, как это наблюдается в случае индановых производных амфетамина, таких как метилендиокси-2-аминоиндан (MDAI), и отсюда следует, что циклический эквивалент норэфедрина, цис-2-амино-1-инданол, при обработке цианогенбромидом также даст 2-аминооксазолины(4). В приведенном ниже примере стереохимия индана составляет 1R,2S, поскольку ожидается, что он будет более мощным, чем энатиомер. Синтез этого соединения лучше всего осуществлять путем внутримолекулярного ацилирования по Фриделю анти/трео 1R,2R бета-гидрокси фенилаланина (5). Однако существуют трудности в получении этого соединения, оно может быть получено аминогидроксилированием циннамата с последующей инверсией Мицунобу (6) или окислением бета-бром-фенилаланина нитратом серебра (7).
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Патент+2101424 (b) примеры использования цианамида натрия для получения 2-аминооксазолинов; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: