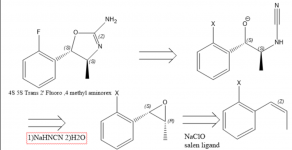
Existe um interesse predominante no 4 Metilaminorex e nos seus derivados, em parte devido à sua escassez. Estudos farmacológicos sugerem que a ordem de potência dos enatiómeros do 4-metilaminorex é trans-4S,5S > cis-4S,5R ~ cis-4R,5S > trans-4R,5R e o trans-metilaminorex racémico é considerado mais potente do que o cis (1). Em 1970, foi publicada uma patente relativa a uma síntese de aminorex a partir de óxido de estireno com a utilização de cianamida (2), o que pode aludir ao facto de que um óxido de estireno enatiopuro ou um óxido de beta-metil-estireno/propenil-benzeno conduziria ao isómero metilaminorex necessário (2). Para obter o derivado 4S,5S, é necessário utilizar o epóxido de 1S,2R propenilbenzeno, uma vez que a estereoquímica nesse centro quiral é invertida. O epóxido é facilmente obtido através da epoxidação de Jacobsen(3), no entanto, não tenho a certeza da melhor forma de obter propenilbenzenos substituídos de forma concisa.

Em segundo lugar, é evidente que é possível obter um novo derivado possivelmente psicoativo da classe das 2 amino-oxazolinas, tal como se verifica com os derivados indanos da anfetamina, como o metilenodioxi 2 amino indano (MDAI), pelo que o equivalente cíclico da norefedrina, cis 2 amino 1 indanol, ao ser tratado com brometo de cianogénio, também produziria 2 amino-oxazolinas(4). No exemplo que se segue, a estereoquímica do indano é 1R,2S, uma vez que se espera que seja mais potente do que o enatiómero. A síntese deste composto seria mais bem conseguida através de uma acilação intra-molecular por friedel crafts da anti/treo 1R,2R beta hidroxi fenilalanina (5). No entanto, existem dificuldades na obtenção deste composto, que poderia ser obtido por uma amino-hidroxilação de um cinamato seguida de inversão de mitsunobu (6) ou por oxidação de uma beta bromo fenilalanina com nitrato de prata (7).


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 b) Exemplos de utilização de hidrogenocianamida de sódio na preparação de 2 amino-oxazolinas; a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Em segundo lugar, é evidente que é possível obter um novo derivado possivelmente psicoativo da classe das 2 amino-oxazolinas, tal como se verifica com os derivados indanos da anfetamina, como o metilenodioxi 2 amino indano (MDAI), pelo que o equivalente cíclico da norefedrina, cis 2 amino 1 indanol, ao ser tratado com brometo de cianogénio, também produziria 2 amino-oxazolinas(4). No exemplo que se segue, a estereoquímica do indano é 1R,2S, uma vez que se espera que seja mais potente do que o enatiómero. A síntese deste composto seria mais bem conseguida através de uma acilação intra-molecular por friedel crafts da anti/treo 1R,2R beta hidroxi fenilalanina (5). No entanto, existem dificuldades na obtenção deste composto, que poderia ser obtido por uma amino-hidroxilação de um cinamato seguida de inversão de mitsunobu (6) ou por oxidação de uma beta bromo fenilalanina com nitrato de prata (7).
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 b) Exemplos de utilização de hidrogenocianamida de sódio na preparação de 2 amino-oxazolinas; a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: