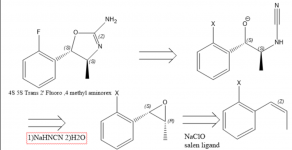
Há um interesse predominante no 4 Metilaminorex e seus derivados, em parte devido à sua escassez. Estudos farmacológicos sugerem que a ordem de classificação das potências dos enatiômeros do 4-metilaminorex é trans-4S,5S > cis-4S,5R ~ cis-4R,5S > trans-4R,5R e o trans-metilaminorex racêmico é considerado mais potente do que o cis (1). Em 1970, foi publicada uma patente relacionada a uma síntese de aminorex a partir de óxido de estireno com o uso de cianamida(2), o que pode aludir ao fato de que um óxido de estireno enatiopuro ou beta metil estireno/óxido de propenil benzeno levaria ao isômero metilaminorex necessário (2). Para obter o derivado 4S,5S, o epóxido de 1S,2R propenilbenzeno deve ser usado porque a estereoquímica nesse centro quiral é invertida. O epóxido pode ser facilmente obtido por meio da epoxidação de Jacobsen(3), mas não tenho certeza da melhor maneira de obter propenilbenzeno substituído de forma concisa.

Em segundo lugar, está claro que um novo derivado possivelmente psicoativo da classe das 2 amino oxazolinas é possível, como se observa com os derivados de indano da anfetamina, como o metilenodioxi 2 amino indano (MDAI) e, portanto, seria possível que o equivalente cíclico da norefedrina, cis 2 amino 1 indanol, ao ser tratado com brometo de cianogênio, também produzisse 2 amino oxazolinas(4). No exemplo fornecido abaixo, a estereoquímica do indano é 1R,2S, pois espera-se que seja mais potente do que o enatiômero. A síntese desse composto seria melhor obtida por meio de uma acilação intra-molecular de friedel crafts de anti/treo 1R,2R beta hidroxi fenilalanina (5). No entanto, há dificuldades na fabricação desse composto, que poderia ser obtido por uma aminohidroxilação de um cinamato seguida de inversão de mitsunobu (6) ou pela oxidação de uma beta bromo fenilalanina com nitrato de prata (7).


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) Exemplos de uso de cianamida hidrogenada de sódio para preparação de 2 amino oxazolinas; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Em segundo lugar, está claro que um novo derivado possivelmente psicoativo da classe das 2 amino oxazolinas é possível, como se observa com os derivados de indano da anfetamina, como o metilenodioxi 2 amino indano (MDAI) e, portanto, seria possível que o equivalente cíclico da norefedrina, cis 2 amino 1 indanol, ao ser tratado com brometo de cianogênio, também produzisse 2 amino oxazolinas(4). No exemplo fornecido abaixo, a estereoquímica do indano é 1R,2S, pois espera-se que seja mais potente do que o enatiômero. A síntese desse composto seria melhor obtida por meio de uma acilação intra-molecular de friedel crafts de anti/treo 1R,2R beta hidroxi fenilalanina (5). No entanto, há dificuldades na fabricação desse composto, que poderia ser obtido por uma aminohidroxilação de um cinamato seguida de inversão de mitsunobu (6) ou pela oxidação de uma beta bromo fenilalanina com nitrato de prata (7).
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) Exemplos de uso de cianamida hidrogenada de sódio para preparação de 2 amino oxazolinas; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: