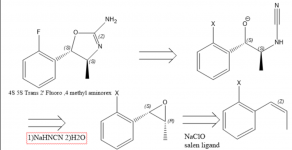
Istnieje powszechne zainteresowanie 4 metyloaminoreksem i jego pochodnymi, częściowo ze względu na jego niedobór. Badania farmakologiczne sugerują, że kolejność siły działania enancjomerów 4-metyloaminoreksu jest następująca: trans-4S,5S > cis-4S,5R ~ cis-4R,5S > trans-4R,5R, a racemiczny trans-metyloaminoreks jest uważany za silniejszy niż cis (1), dlatego ukierunkowana synteza w kierunku enancjomeru trans 4S, 5S jest bardzo pożądana. W 1970 r. opublikowano patent odnoszący się do syntezy aminoreksu z tlenku styrenu przy użyciu cyjanamidu (2), co może nawiązywać do faktu, że enatiopurowy tlenek styrenu lub beta-metylostyren/tlenek propenylobenzenu doprowadziłby do wymaganego izomeru metyloaminoreksu (2). Aby otrzymać pochodną 4S,5S, należy użyć epoksydu 1S,2R propenylobenzenu, ponieważ stereochemia w tym centrum chiralnym jest odwrócona. Epoksyd można łatwo otrzymać poprzez epoksydację Jacobsena (3), jednak nie jestem pewien najlepszego sposobu na zwięzłe otrzymanie podstawionego propenylobenzenu.

Po drugie, jasne jest, że nowa potencjalnie psychoaktywna pochodna klasy 2-aminooksazoliny jest możliwa, jak widać w przypadku indanowych pochodnych amfetaminy, takich jak metylenodioksy-2-aminoindan (MDAI), a zatem wynikałoby z tego, że cykliczny odpowiednik norefedryny, cis 2-amino-1indanol, po potraktowaniu bromkiem cyjanogenu również dawałby 2-aminooksazoliny(4). W podanym poniżej przykładzie stereochemia indanu to 1R,2S, ponieważ oczekuje się, że będzie on silniejszy niż enancjomer. Syntezę tego związku najlepiej byłoby przeprowadzić poprzez wewnątrzcząsteczkową acylację friedela anty/treo 1R,2R beta hydroksy fenyloalaniny (5). Istnieją jednak trudności w wytworzeniu tego związku, można to osiągnąć przez aminohydroksylację cynamonianu, a następnie inwersję mitsunobu (6) lub przez utlenianie beta-bromo fenyloalaniny azotanem srebra (7).


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) przykłady zastosowania wodorocjanamidu sodu do przygotowania 2-aminooksazolin; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Po drugie, jasne jest, że nowa potencjalnie psychoaktywna pochodna klasy 2-aminooksazoliny jest możliwa, jak widać w przypadku indanowych pochodnych amfetaminy, takich jak metylenodioksy-2-aminoindan (MDAI), a zatem wynikałoby z tego, że cykliczny odpowiednik norefedryny, cis 2-amino-1indanol, po potraktowaniu bromkiem cyjanogenu również dawałby 2-aminooksazoliny(4). W podanym poniżej przykładzie stereochemia indanu to 1R,2S, ponieważ oczekuje się, że będzie on silniejszy niż enancjomer. Syntezę tego związku najlepiej byłoby przeprowadzić poprzez wewnątrzcząsteczkową acylację friedela anty/treo 1R,2R beta hydroksy fenyloalaniny (5). Istnieją jednak trudności w wytworzeniu tego związku, można to osiągnąć przez aminohydroksylację cynamonianu, a następnie inwersję mitsunobu (6) lub przez utlenianie beta-bromo fenyloalaniny azotanem srebra (7).
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) przykłady zastosowania wodorocjanamidu sodu do przygotowania 2-aminooksazolin; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: