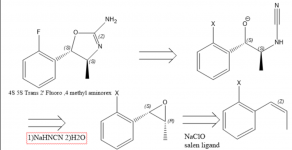
C'è un interesse prevalente per il 4 Metilaminorex e i suoi derivati, in parte dovuto alla sua scarsità. Studi farmacologici suggeriscono che l'ordine di potenza degli enatiomeri del 4 Metilaminorex è trans-4S,5S > cis-4S,5R ~ cis-4R,5S > trans-4R,5R e il trans metilaminorex racemico è considerato più potente del cis (1), pertanto una sintesi diretta verso l'enatiomero trans 4S, 5S è molto auspicabile. Nel 1970 viene pubblicato un brevetto relativo a una sintesi di Aminorex da ossido di stirene con l'uso di cianamide(2), che può alludere al fatto che un ossido di stirene enatiopuro o beta metil stirene/ossido di propenile benzene porterebbe all'isomero metilaminorex richiesto (2). Per ottenere il derivato 4S,5S, è necessario utilizzare l'epossido di 1S,2R propenilbenzene, poiché la stereochimica in quel centro chirale è invertita. L'epossido è facilmente ottenibile tramite epossidazione di Jacobsen(3), ma non sono sicuro del modo migliore per ottenere in modo conciso il propenilbenzene sostituito.

In secondo luogo, è chiaro che è possibile ottenere un nuovo derivato possibilmente psicoattivo della classe delle 2 amino-ossazoline, come si è visto con i derivati indani dell'anfetamina, come il metilendiossi 2 amino-indano (MDAI), e quindi ne consegue che l'equivalente ciclico della norefedrina, il cis 2 amino 1 indanolo, al trattamento con bromuro di cianogeno darebbe anche 2 amino-ossazoline(4). Nell'esempio riportato di seguito, la stereochimica dell'indano è 1R,2S, poiché ci si aspetta che sia più potente dell'enatiomero. La sintesi di questo composto si otterrebbe meglio con un'acilazione intra-molecolare friedel crafts di anti/treo 1R,2R beta idrossi fenilalanina (5). Tuttavia, la produzione di questo composto presenta delle difficoltà; esso potrebbe essere ottenuto mediante un'aminoidrossilazione di un cinnamato seguita da un'inversione di Mitsunobu (6) o dall'ossidazione di una beta-bromo-fenilalanina con nitrato d'argento (7).


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) esempi di utilizzo dell'idrogeno cianammide di sodio per la preparazione di 2 amino ossazoline; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
In secondo luogo, è chiaro che è possibile ottenere un nuovo derivato possibilmente psicoattivo della classe delle 2 amino-ossazoline, come si è visto con i derivati indani dell'anfetamina, come il metilendiossi 2 amino-indano (MDAI), e quindi ne consegue che l'equivalente ciclico della norefedrina, il cis 2 amino 1 indanolo, al trattamento con bromuro di cianogeno darebbe anche 2 amino-ossazoline(4). Nell'esempio riportato di seguito, la stereochimica dell'indano è 1R,2S, poiché ci si aspetta che sia più potente dell'enatiomero. La sintesi di questo composto si otterrebbe meglio con un'acilazione intra-molecolare friedel crafts di anti/treo 1R,2R beta idrossi fenilalanina (5). Tuttavia, la produzione di questo composto presenta delle difficoltà; esso potrebbe essere ottenuto mediante un'aminoidrossilazione di un cinnamato seguita da un'inversione di Mitsunobu (6) o dall'ossidazione di una beta-bromo-fenilalanina con nitrato d'argento (7).
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) esempi di utilizzo dell'idrogeno cianammide di sodio per la preparazione di 2 amino ossazoline; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: