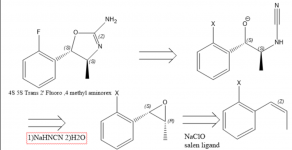
Le 4 Methylaminorex et ses dérivés suscitent un intérêt croissant, notamment en raison de leur rareté. Des études pharmacologiques suggèrent que l'ordre de puissance des énatiomères du 4 méthylaminorex est trans-4S,5S > cis-4S,5R ~ cis-4R,5S > trans-4R,5R et le méthylaminorex trans racémique est considéré comme plus puissant que le cis (1), c'est pourquoi une synthèse dirigée vers l'énatiomère trans 4S, 5S est très souhaitable. En 1970, un brevet est publié concernant une synthèse d'Aminorex à partir d'oxyde de styrène avec l'utilisation de cyanamide(2), ce qui peut faire allusion au fait qu'un oxyde de styrène énatiopur ou un oxyde de bêta-méthylstyrène/propénylbenzène conduirait à l'isomère méthylaminorex requis (2). Pour obtenir le dérivé 4S,5S, il faut utiliser l'époxyde de propénylbenzène 1S,2R, car la stéréochimie de ce centre chiral est inversée. L'époxyde est facilement obtenu par époxydation de Jacobsen (3), mais je ne suis pas sûr de la meilleure façon d'obtenir des benzènes propényliques substitués de manière concise.

Deuxièmement, il est clair qu'un nouveau dérivé éventuellement psychoactif de la classe des 2 amino oxazolines est possible, comme on le voit avec les dérivés indanes de l'amphétamine tels que le méthylènedioxy 2 amino indane (MDAI), et il s'ensuit que l'équivalent cyclique de la noréphédrine, le cis 2 amino 1 indanol, donnerait également des 2 amino oxazolines après traitement au bromure de cyanogène(4). Dans l'exemple ci-dessous, la stéréochimie de l'indane est 1R,2S car il devrait être plus puissant que l'énatiomère. La meilleure façon de synthétiser ce composé serait de procéder à une acylation intra-moléculaire de type friedel crafts de l'anti/thréo 1R,2R bêta-hydroxyphénylalanine (5). Toutefois, la fabrication de ce composé présente des difficultés ; il pourrait être obtenu par aminohydroxylation d'un cinnamate suivie d'une inversion de Mitsunobu (6) ou par oxydation d'une bêta-bromo phénylalanine avec du nitrate d'argent (7).


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) exemples d'utilisation d'hydrogénocyanamide de sodium pour la préparation de 2 amino oxazolines ; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc. 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Deuxièmement, il est clair qu'un nouveau dérivé éventuellement psychoactif de la classe des 2 amino oxazolines est possible, comme on le voit avec les dérivés indanes de l'amphétamine tels que le méthylènedioxy 2 amino indane (MDAI), et il s'ensuit que l'équivalent cyclique de la noréphédrine, le cis 2 amino 1 indanol, donnerait également des 2 amino oxazolines après traitement au bromure de cyanogène(4). Dans l'exemple ci-dessous, la stéréochimie de l'indane est 1R,2S car il devrait être plus puissant que l'énatiomère. La meilleure façon de synthétiser ce composé serait de procéder à une acylation intra-moléculaire de type friedel crafts de l'anti/thréo 1R,2R bêta-hydroxyphénylalanine (5). Toutefois, la fabrication de ce composé présente des difficultés ; il pourrait être obtenu par aminohydroxylation d'un cinnamate suivie d'une inversion de Mitsunobu (6) ou par oxydation d'une bêta-bromo phénylalanine avec du nitrate d'argent (7).
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) exemples d'utilisation d'hydrogénocyanamide de sodium pour la préparation de 2 amino oxazolines ; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc. 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: