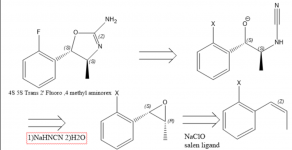
Existe un gran interés por el 4 Metilaminorex y sus derivados, en parte debido a su escasez. Los estudios farmacológicos sugieren que el orden de potencia de los enatiómeros del 4 metilaminorex es trans-4S,5S > cis-4S,5R ~ cis-4R,5S > trans-4R,5R y que el trans metilaminorex racémico se considera más potente que el cis (1), por lo que es muy deseable una síntesis dirigida hacia el enatiómero trans 4S, 5S. En 1970 se publica una patente relativa a una síntesis de Aminorex a partir de óxido de estireno con el uso de cianamida(2), que puede aludir al hecho de que un óxido de estireno enatiopuro o un óxido de beta metil estireno/ propenil benceno conduciría al isómero Metilaminorex requerido (2). Para obtener el derivado 4S,5S, debe utilizarse el epóxido de propenilbenceno 1S,2R porque la estereoquímica en ese centro quiral está invertida. El epóxido se puede obtener fácilmente por epoxidación de Jacobsen (3), pero no estoy seguro de cuál es la mejor manera de obtener bencenos de propenilo sustituidos de forma concisa.

En segundo lugar, está claro que es posible obtener un nuevo derivado posiblemente psicoactivo de la clase de las 2 amino oxazolinas, como se ha visto con los derivados indanos de la anfetamina, como el metilendioxi 2 amino indano (MDAI) y, por lo tanto, se deduciría que el equivalente cíclico de la norefedrina, el cis 2 amino 1 indanol, al tratarlo con bromuro de cianógeno también produciría 2 amino oxazolinas(4). En el ejemplo que se presenta a continuación, la estereoquímica del indano es 1R,2S, ya que se espera que sea más potente que el enatiómero. La síntesis de este compuesto se lograría mejor mediante una acilación intra molecular friedel artesanal de anti/threo 1R,2R beta hidroxi fenilalanina (5). Sin embargo, existen dificultades para fabricar este compuesto, podría lograrse mediante una aminohidroxilación de un cinamato seguida de una inversión mitsunobu (6) o por oxidación de una beta bromo fenilalanina con nitrato de plata (7).


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) ejemplos de uso de cianamida de hidrógeno sódico para la preparación de 2 amino oxazolinas; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
En segundo lugar, está claro que es posible obtener un nuevo derivado posiblemente psicoactivo de la clase de las 2 amino oxazolinas, como se ha visto con los derivados indanos de la anfetamina, como el metilendioxi 2 amino indano (MDAI) y, por lo tanto, se deduciría que el equivalente cíclico de la norefedrina, el cis 2 amino 1 indanol, al tratarlo con bromuro de cianógeno también produciría 2 amino oxazolinas(4). En el ejemplo que se presenta a continuación, la estereoquímica del indano es 1R,2S, ya que se espera que sea más potente que el enatiómero. La síntesis de este compuesto se lograría mejor mediante una acilación intra molecular friedel artesanal de anti/threo 1R,2R beta hidroxi fenilalanina (5). Sin embargo, existen dificultades para fabricar este compuesto, podría lograrse mediante una aminohidroxilación de un cinamato seguida de una inversión mitsunobu (6) o por oxidación de una beta bromo fenilalanina con nitrato de plata (7).
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) ejemplos de uso de cianamida de hidrógeno sódico para la preparación de 2 amino oxazolinas; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: