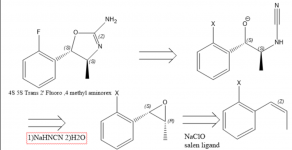
Das Interesse an 4 Methylaminorex und seinen Derivaten ist groß, was zum Teil auf seine Knappheit zurückzuführen ist. Pharmakologische Studien deuten darauf hin, dass die Rangfolge der Potenzen von 4 Methylaminorex-Enatiomeren trans-4S,5S > cis-4S,5R ~ cis-4R,5S > trans-4R,5R ist und racemisches Trans-Methylaminorex als potenter gilt als cis (1), weshalb eine gezielte Synthese zum Trans-4S,5S-Enatiomer sehr wünschenswert ist. 1970 wird ein Patent veröffentlicht, das sich auf die Synthese von Aminorex aus Styroloxid unter Verwendung von Cyanamid bezieht (2), was darauf hinweisen kann, dass ein enatiopures Styroloxid oder Beta-Methylstyrol/Propenylbenzoloxid zum gewünschten Methylaminorex-Isomer führen würde (2). Um das 4S,5S-Derivat zu erhalten, muss das 1S,2R-Propenylbenzolepoxid verwendet werden, da die Stereochemie an diesem chiralen Zentrum invertiert ist. Das Epoxid ist leicht über die Jacobsen-Epoxidierung(3) zu erhalten, aber ich bin mir nicht sicher, wie man substituiertes Propenylbenzol am besten erhält.

Zweitens ist klar, dass ein neues, möglicherweise psychoaktives Derivat der 2-Amino-Oxazolin-Klasse möglich ist, wie es bei Indanderivaten von Amphetamin wie Methylendioxy-2-Amino-Indan (MDAI) zu sehen ist, und daraus würde folgen, dass das zyklische Äquivalent von Norephedrin, cis-2-Amino-1-Indanol, bei Behandlung mit Bromcyan ebenfalls 2-Amino-Oxazoline ergeben würde(4). In dem nachstehenden Beispiel ist die Stereochemie des Indans 1R,2S, da man davon ausgeht, dass es wirksamer ist als das Enatiomer. Die Synthese dieser Verbindung ließe sich am besten durch eine intra-molekulare Friedel-Handwerk-Acylierung von anti/threo 1R,2R Beta-Hydroxy-Phenylalanin (5) erreichen. Es gibt jedoch Schwierigkeiten bei der Herstellung dieser Verbindung, sie könnte durch eine Aminohydroxylierung eines Cinnamats, gefolgt von einer Mitsunobu-Inversion (6) oder durch Oxidation eines Beta-Bromphenylalanins mit Silbernitrat (7) erreicht werden.


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) Beispiele für die Verwendung von Natriumhydrogencyanamid zur Herstellung von 2-Amino-Oxazolinen; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Zweitens ist klar, dass ein neues, möglicherweise psychoaktives Derivat der 2-Amino-Oxazolin-Klasse möglich ist, wie es bei Indanderivaten von Amphetamin wie Methylendioxy-2-Amino-Indan (MDAI) zu sehen ist, und daraus würde folgen, dass das zyklische Äquivalent von Norephedrin, cis-2-Amino-1-Indanol, bei Behandlung mit Bromcyan ebenfalls 2-Amino-Oxazoline ergeben würde(4). In dem nachstehenden Beispiel ist die Stereochemie des Indans 1R,2S, da man davon ausgeht, dass es wirksamer ist als das Enatiomer. Die Synthese dieser Verbindung ließe sich am besten durch eine intra-molekulare Friedel-Handwerk-Acylierung von anti/threo 1R,2R Beta-Hydroxy-Phenylalanin (5) erreichen. Es gibt jedoch Schwierigkeiten bei der Herstellung dieser Verbindung, sie könnte durch eine Aminohydroxylierung eines Cinnamats, gefolgt von einer Mitsunobu-Inversion (6) oder durch Oxidation eines Beta-Bromphenylalanins mit Silbernitrat (7) erreicht werden.
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (b) Beispiele für die Verwendung von Natriumhydrogencyanamid zur Herstellung von 2-Amino-Oxazolinen; (a) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (b) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (a) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (a) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c,(b) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: