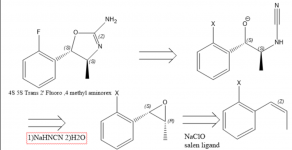
Преобладава интересът към 4 Метиламинорекс и неговите производни, което отчасти се дължи на неговата рядкост. Фармакологичните изследвания показват, че редът на ефикасност на енациомерите на 4 Methylaminorex е trans-4S,5S > cis-4S,5R ~ cis-4R,5S > trans-4R,5R, а рацемичният Trans methylaminorex се счита за по-ефикасен от cis (1), поради което насоченият синтез към Trans 4S, 5S енациомера е много желан. През 1970 г. е публикуван патент, отнасящ се до синтез на Аминорекс от стиренов оксид с използване на цианамид (2), което може да намеква за факта, че енаториално чист стиренов оксид или бета-метил стирен/пропенил бензолен оксид би довел до необходимия изомер на Метиламинорекс (2). За да се получи производното 4S,5S, трябва да се използва 1S,2R пропенилбензолен епоксид, тъй като стереохимията в този хирален център е обърната. Епоксидът се получава лесно чрез епоксидиране по Якобсен (3), но не съм сигурен за най-добрия начин за кратко получаване на заместени пропенилбензоли.

Второ, ясно е, че е възможно да се получи ново евентуално психоактивно производно от класа на 2-аминооксазолините, както се наблюдава при индановите производни на амфетамина, като метилендиокси 2-аминоиндан (MDAI), и следователно би следвало, че цикличният еквивалент на норефедрина, цис 2-амино 1 инданол, при третиране с цианогенбромид също би дал 2-аминооксазолини(4). В примера, даден по-долу, стереохимията на индана е 1R,2S, тъй като се очаква той да бъде по-силен от енациомера. Синтезът на това съединение най-добре би се постигнал чрез вътрешномолекулно ацилиране на анти/трео 1R,2R бета хидрокси фенилаланин (5). Въпреки това съществуват трудности при получаването на това съединение, то би могло да се постигне чрез аминохидроксилиране на цинамат, последвано от инверсия на мицунобу (6), или чрез окисление на бета-бромо фенилаланин със сребърен нитрат (7).


(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (б) примери за използване на натриев водороден цианамид за приготвяне на 2-аминооксазолини; (а) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (а) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (б) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (а) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (а) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c, (б) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Второ, ясно е, че е възможно да се получи ново евентуално психоактивно производно от класа на 2-аминооксазолините, както се наблюдава при индановите производни на амфетамина, като метилендиокси 2-аминоиндан (MDAI), и следователно би следвало, че цикличният еквивалент на норефедрина, цис 2-амино 1 инданол, при третиране с цианогенбромид също би дал 2-аминооксазолини(4). В примера, даден по-долу, стереохимията на индана е 1R,2S, тъй като се очаква той да бъде по-силен от енациомера. Синтезът на това съединение най-добре би се постигнал чрез вътрешномолекулно ацилиране на анти/трео 1R,2R бета хидрокси фенилаланин (5). Въпреки това съществуват трудности при получаването на това съединение, то би могло да се постигне чрез аминохидроксилиране на цинамат, последвано от инверсия на мицунобу (6), или чрез окисление на бета-бромо фенилаланин със сребърен нитрат (7).
(1) https://web.archive.org/web/2007093...am/journal_v3_num34/journal_v3_num34_pg6.html
(2) https://patents.google.com/patent/DE2101424A1/en?oq=DE+Patent+2101424 (б) примери за използване на натриев водороден цианамид за приготвяне на 2-аминооксазолини; (а) http://tch.ucsd.edu/pdfs/EJOC_7337_2013.pdf
(3) E. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc., 1991, 113, 7063-7064
(4) (а) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jm00339a011 / https://pubs.acs.org/doi/10.1021/jm00339a011 (б) https://www.erowid.org/archive/rhodium/chemistry/4-mar.stereoisomers.html
(5) (а) http://koreascience.or.kr/article/JAKO200602727234043.pdf
(6) (а) https://sci-hub.hkvisa.net/https://doi.org/10.1021/jo010482c, (б) https://sci-hub.hkvisa.net/10.1039/C3RA44631J
(7) https://sci-hub.hkvisa.net/10.1021/jo061159i
Attachments
Last edited by a moderator: